Kiseline, baze i soli

Naziv "Oxygen" se dogodio jer je prethodno pretpostavljeno da kiseonik daje spojeve svojstava kiselina. Pogreška, naravno, otkrivena. Kao što smo već vidjeli, kisela svojstva određena su vodikom, koja ima sve kiseline. Pogrešan zaključak pojavili su se iz promatranja, koje se kiseline formiraju prilikom rastvaranog nemetalnog oksida u vodi. Tipični predstavnici nemetalnih oksida - sumporni dioksid (tako2) i ugljični dioksid (CO2). Oboje su proizvodi izgaranja, tako2 - Razlog za preteraciju evropskih jezera sa kiselinama. Dok tako2 smatra se prvenstveno kao okruženje zagađivače, co2 Igra ključnu ulogu u mnogim biološkim procesima (vidi. "Ugljični dioksid u karbonatnom sistemu"). Ovi spojevi su nam poznati, prvenstveno kao plinovi, a ne kao kiselina. Možemo razgovarati o njima kao kiseline ako se rastvaraju u vodi. To često dovodi do nesporazuma, posebno za CO2 (ugljični dioksid), jer se ovaj plin označava kao koalična kiselina. Kiselina, T.E. H2Co3, Javlja se, prirodno, samo kad plin reagira s vodom.
Co2+ H2O => H2Co3
U raspuštanju ugljičnog dioksida u vodi povećava svoju provodljivost (provodljiva sposobnost). Kao rezultat toga, formiraju ioni. Ova reakcija može se zabilježiti sljedećim jednadžbima:
H2Co3+H2O => H3O+ + HCO3-.
U ovom slučaju se formiraju hidroksonijum i ioni hidrokadarbonata. Koalična kiselina pretrpjela je jedinicu punjenja u obliku hidrogen iona. Budući da su nosači pozitivnog naboja protoni, očito je da je bikarbonat protoni donator. Proton - Pozitivna jedinica za punjenje. U osnovi su kiseline donatori protona! Suprotnost kiselinama - baza (alkalija), koja se formiraju prilikom rastvaranja metalnih oksida - kisik i metalne reakcijske proizvode u vodi. Tipični predstavnici ove grupe su kalijum hidroksid (Con) i natrijum hidroksid (NAOH). ALKALI su protonski akumulatori: prihvaćaju nosioce pozitivnog naboja. Ako su kiseline i alkalije u isto vrijeme u rješenjima, oni reagiraju jedni s drugima, kao rezultat toga su u potpunosti ili djelomično neutralizirani. Kao proizvod reakcije, naravno, formiraju se soli, što povećava provodljivost vode. Dakle, sa reakcijom NaOH (natrijum hidroksid) sa HCl (hlorovodična kiselina), formirana je tablica (NACL).
Naoh + hcl => Nacl + H2O.
Gore opisana pH vrijednost pokazuje nam samo koji sudionik reakcije, na kraju, prisutan je u višku. PH vrijednost neće dati nikakve informacije o učesnicima i reakcijskim proizvodima. PH vrijednost se može smatrati rezultat koji nam daje informacije. Poznavanje pH vrijednosti, iako vrlo korisno, mora se upotpuniti, međutim, ako je potrebno, ostali mjerljivi pokazatelji i zapažanja. Najvažniji parametar koji utječe na pH vrijednosti u našem akvarijumu - ugljični dioksid unutar karbonatnog sistema. Ovi problemi su osvijetljeni dalje.
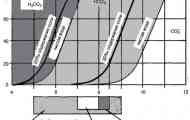 Ugljični dioksid u karbonatnom sistemu
Ugljični dioksid u karbonatnom sistemu Oprema za morski akvarijum
Oprema za morski akvarijum Sadržaj i njegu u rogu
Sadržaj i njegu u rogu Krstarenje: opis, prikazi, fotografije
Krstarenje: opis, prikazi, fotografije Monodaktil ili monodaktilusni srebrni sadržaj i opis
Monodaktil ili monodaktilusni srebrni sadržaj i opis Isoetes malinvernianum ces. Et de ne.- vilje
Isoetes malinvernianum ces. Et de ne.- vilje Gorchak riba u akvarijumu - sadržaj i uzgoj.
Gorchak riba u akvarijumu - sadržaj i uzgoj. Glass perch: opis, sadržaj, reprodukcija, fotografija, video
Glass perch: opis, sadržaj, reprodukcija, fotografija, video Šta nedostaju akvarijske biljke?
Šta nedostaju akvarijske biljke? Aquaseper - prirodni akvarijum.
Aquaseper - prirodni akvarijum. Dimidiochromis kompresije: sadržaj, hranjenje, uzgoj, fotografija, video
Dimidiochromis kompresije: sadržaj, hranjenje, uzgoj, fotografija, video Mramorni karcinom: opis, sadržaj u akvarijumu, fotografija, uzgoj
Mramorni karcinom: opis, sadržaj u akvarijumu, fotografija, uzgoj Kako identificirati amonijak u akvarijumu i kako se nositi s njim?
Kako identificirati amonijak u akvarijumu i kako se nositi s njim? Pisks: opis, sadržaj, reprodukcija, fotografija, njega
Pisks: opis, sadržaj, reprodukcija, fotografija, njega Crab vampir: sadržaj, opis, fotografija
Crab vampir: sadržaj, opis, fotografija Mutna voda u akvarijumu: šta učiniti je problem, fotografija, video
Mutna voda u akvarijumu: šta učiniti je problem, fotografija, video Akvarijska riba iz različitih vrsta porodica
Akvarijska riba iz različitih vrsta porodica Šta učiniti ako je akvarijum zelen?
Šta učiniti ako je akvarijum zelen? Poklopac za akvarijum sa vlastitim rukama: fotografija, video
Poklopac za akvarijum sa vlastitim rukama: fotografija, video Acidoza i alkaloza u ribi - znakovi, razlozi, liječenje, fotografija
Acidoza i alkaloza u ribi - znakovi, razlozi, liječenje, fotografija Kako održati čist u akvarijumu?
Kako održati čist u akvarijumu?